個性化癌癥疫苗可提高免疫療法的有效性
mRNA腫瘤疫苗 + 阿替利珠單抗(Atezolizumab)用于晚期實體癌
RO7198457一種基于信使RNA(mRNA)的新抗原特異性疫苗,有望通過增加新抗原特異性T細(xì)胞來增強(qiáng)免疫檢查點抑制劑(ICI)的抗腫瘤作用。
英國皇家馬斯登醫(yī)院的Juanita Lopez在美國癌癥研究協(xié)會(AACRVirtual Annual Meetings Ⅱ,6月22~24日,線上)上報道了RO7198457在局部晚期/轉(zhuǎn)移性實體瘤患者中的Ib期臨床試驗結(jié)果

每位患者都擁有自己的腫瘤特異性新抗原
RO7198457是根據(jù)每位患者量身定制的“個性化癌癥疫苗”。需要對患者的血液樣品和腫瘤組織進(jìn)行序列分析,并鑒定多達(dá)20種腫瘤特異性新抗原,然后合成相應(yīng)的mRNA以制備脂質(zhì)體制劑并靜脈回輸?shù)饺梭w。疫苗會刺激先天的免疫系統(tǒng),并通過抗原呈遞細(xì)胞(DC細(xì)胞)激活靶向新抗原的抗腫瘤免疫力。
此次研究,我們針對符合以下標(biāo)準(zhǔn)的患者:
(1)18歲或以上;
(2)晚期或復(fù)發(fā)性實體癌;
(3)預(yù)期壽命超過12周,
(4)全身狀況(ECOG PS評分)為1以下。
該測試以21天為1個周期。RO7198457給藥:前面2個周期每周一次;第3個周期每2周一次。只要沒有病情沒有進(jìn)展,在第7和第13個周期,以及每8個周一次。阿替利珠單抗(Atezolizumab)每3周一次。
【主要終點】:藥物的安全性和耐受性
【次要終點】: 最大耐受劑量,II期試驗的推薦劑量,藥代動力學(xué),抗腫瘤活性。
這項研究分為劑量遞增隊列(30名受試者)和劑量擴(kuò)展隊列(114名受試者)。劑量擴(kuò)展隊列中,曾經(jīng)接受過ICI治療42例,未曾接受過ICI治療72例。
從劑量遞增隊列和劑量擴(kuò)展隊列(有/無ICI)的患者背景來看
《中位年齡》:57.5歲,61.5歲/57.5歲;
《ECOG PS 0分》:50.0%,45.2%/ 52.8%;
《轉(zhuǎn)移性病變?nèi)碇委煹闹形恢委熓贰罚?線,3線/ 2線;
《ICI治療史》:43.3%,100%/ 0%;
《PD-L1表達(dá)腫瘤浸潤免疫細(xì)胞(IC)或腫瘤細(xì)胞(TC)》
<5%的是80.0%,50.0%/ 75.0%,
≥5%或更高的是16.7%,28.6%/ 13.9%。
在劑量遞增隊列中,大腸癌占30%,黑色素瘤占16.7%,直腸癌和腎細(xì)胞癌各占10%。
在劑量擴(kuò)展列隊中
接受過ICI治療的,非小細(xì)胞肺癌(NSCLC)為71.4%,黑色素瘤率為19.0%;未經(jīng)ICI治療的非小細(xì)胞肺癌為13.9%,黑色素瘤和腎細(xì)胞癌各為12.5%,三陰性乳腺癌占33.3%,尿路癌占13.9%。
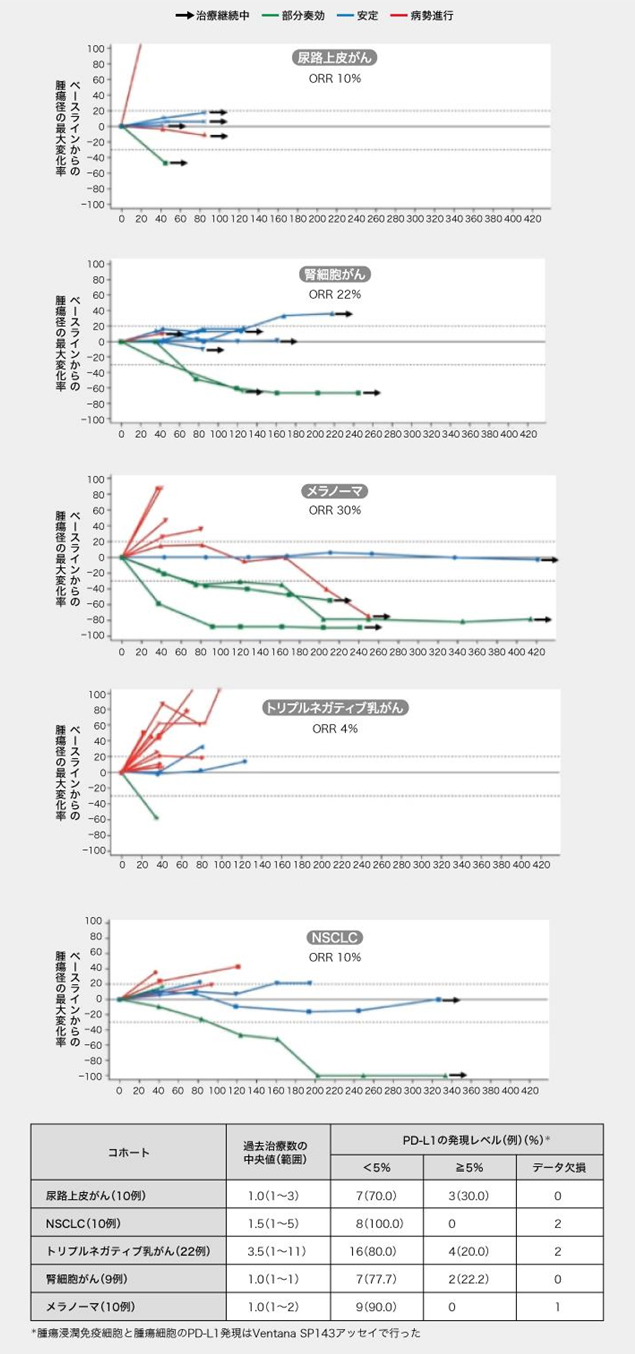
疫苗有效率: 22%的腎細(xì)胞癌,39%的黑素瘤
從這兩個隊列的總共144例受試者的RO7198457劑量來看,15μg為27例,25μg為95例,38μg為11例,50μg為9例;RO7198457按劑量劃分的中位治療期分別為65天, 57天, 64天, 36天;阿替利珠單抗的中位治療時間分別為104天,64天,106天,22天。開始治療后的6周內(nèi),分別有2例,19例,1例和2例患者因疾病進(jìn)展而中斷治療。
不良反應(yīng)中,常見發(fā)燒和畏寒。但總體上都是一過性的,而重癥。在個劑量級別中均未觀察到毒性限制劑量。
當(dāng)通過ELISPOT方法和MHC多聚體方法評估疫苗接種后的新抗原反應(yīng)時,進(jìn)行評估的63例病例中,有46例(73%)發(fā)現(xiàn)了新抗原特異性反應(yīng),中位值為2.6(范圍1-9)。 有14例均與CD4和CD8陽性T細(xì)胞發(fā)生了反應(yīng)。
未接受過ICI治療的劑量擴(kuò)展隊列的患者中, 聯(lián)用RO7198457(25μg )和阿替利珠單抗的客觀緩解率(ORR),在尿路癌中為10%,在腎細(xì)胞癌中為22%,在黑色素瘤中為30%,在三陰性乳腺癌中為4%,在非小細(xì)胞肺癌中為10%。
圖表:未接受過ICI治療患者的緩解率狀況(根據(jù)AACR 2020發(fā)布的數(shù)據(jù)創(chuàng)建)
根據(jù)以上研究數(shù)據(jù),Lopez說:“一般來說,RO7198457聯(lián)用阿替利珠單抗的組合耐受性良好,尚無最大耐受劑量,也未觀察到毒性劑量限制” ,“這種組合在大多數(shù)患者中可激活炎性細(xì)胞因子的釋放和外周T細(xì)胞反應(yīng)。”
目前,作為RO7198457的II期臨床試驗,研究者們正在驗證與pembrolizumab(派姆單抗)聯(lián)合用于一線治療黑色素瘤患者和聯(lián)用atezolizumab(阿替利珠單抗)作為NSCLC患者術(shù)后輔助治療的可行性。


