胰腺癌藥物治療的進展
隨著世界人口老齡化日益嚴重,胰腺癌患者的數量不斷增加,目前已經超過肝癌,成為死亡人數排名第四的癌種。日本國立癌癥中心醫院肝膽胰內科主任奧坂拓志和日本杏林大學腫瘤學教授古瀬純司對世界各國胰腺癌藥物治療的臨床數據進行了回顧性研究,并將研究結果發表在《美國胃腸病學》雜志上 (2020; 55: 369-382)。
●術前輔助化療:確立標準治療方案仍需證據
奧坂拓志團隊改善胰腺癌預后的研究如下:
(1)確立可切除胰腺癌的早期診斷方法
(2)確立復發/不可切除的晚期胰腺癌的非手術治療方法。并在近年來的臨床研究中表現出喜人的結果,新的標準治療方法也在不斷開發中。
胰腺癌根治性切除術后復發率高,預后極差。現階段很多臨床試驗正在探索切除前后實施化療和放化療的治療效果。這些實驗結果表明,術后輔助化療已被認定為標準治療,但術前輔助化療還是缺乏大規模隨機對照試驗(RCT)研究作為Ⅰ類證據支持。
在來自2019年度美國臨床腫瘤學會胃腸道癌研討會(ASCO-GI 2019)上的報告稱,在日本,吉西他濱聯合S-1的術前輔助化療顯著延長了可切除胰腺癌患者的總生存期(OS)。該結果來自Prep-02 / JSAP-05的II / III期隨機試驗(Jpn J Clin Oncol 2019; 49: 190-194)。同時發現,交界可切除胰腺癌病例也出現了總生存期延長的跡象。
此外, 2018年度美國臨床腫瘤學會(ASCO 2018)報道,在荷蘭進行的PREOPANC-1 / III期臨床試驗的結果表明,術前輔助化療有助于延長胰腺癌患者的總生存期(OS)(J Clin Oncol 2020年2月27日線上版)。
對于交界可切除胰腺癌,包括《2019年胰腺癌治療指南》的各國指南均建議術前輔助化療,但尚無既定方案。正在進行的一些隨機對照試驗(RCT)中,日本的GABARNANCE II / III期試驗正在比較吉西他濱聯合nab-紫杉醇與S-1放化療。有望成為標準療法的新證據。
●術后輔助化療:日本較常用S-1方案
上世紀90年代以來,有3項隨機對照試驗研究了僅手術切除和手術切除+術后輔助化療的治療效果。
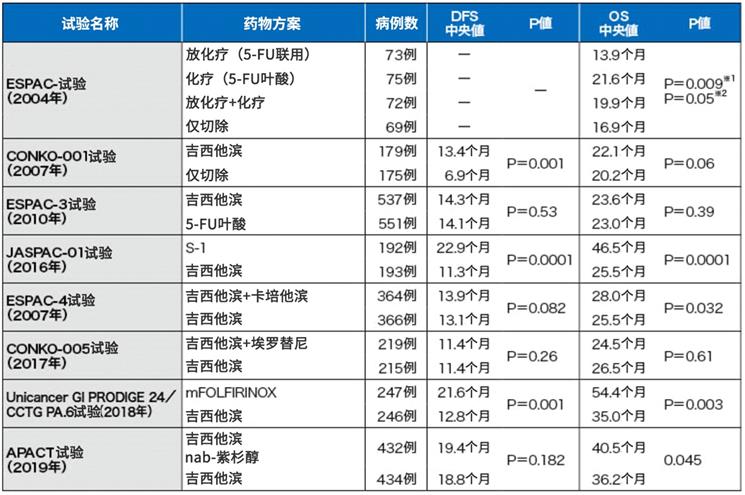
在德國和奧地利進行的III期CONKO-001試驗的研究結果顯示,術后吉西他濱輔助化療顯著延長了患者的無病生存期(DFS)(JAMA 2007; 297: 267-277))。長期隨訪后發現患者的總生存期(OS)也得到了顯著改善(JAMA 2013; 310: 1473-1481)。
在日本進行的JSAP-02 / III期試驗顯示了同樣的研究結果(Br J Cancer 2009; 101: 908-915)。
在日本和歐洲等國實施的ESPAC-3 / III期試驗對比了僅手術切除,術后氟尿嘧啶+葉酸輔助化療,以及術后單用吉西他濱化療三個組群。結果顯示,術后輔助化療可延長患者總生存期(OS),而且,術后單用吉西他濱化療組的嚴重不良事件發生率也得到了顯著降低(JAMA 2012; 308: 147-156)。
鑒于以上這些試驗結果,吉西他濱被認為是術后輔助化療的國際標準。
但是在日本的JASPAC 01 / III期試驗結果顯示,對比單用吉西他濱,單用S-1更加能顯著延長總生存期(OS)(Lancet 2016; 388: 248-257)。而S-1尚未被歐美人群認可。
在歐美國家進行的ESPAC-4 / III期試驗(Lancet 2017; 389: 1011-1024)結果顯示,吉西他濱聯用卡培他濱的組合,比單用吉西他濱更能有效延長總生存期(OS)。
在PRODIGE 24-ACCORD 24/CCTG PA 6 / III期試驗(N Engl J Med 2018; 379: 2395-2406)中,結果顯示mFOLFIRINOX(奧沙利鉑、亞葉酸鈣、伊立替康,5-FU)對比單用吉西他濱,無病生存期(DFS)和總生存期(OS)都得到了顯著延長。但是,由于沒有對比單用S-1、吉西他濱聯用卡培他濱,以及mFOLFIRINOX的臨床試驗,因此尚不清楚哪個是術后輔助療法的最佳方案。
綜上所述,在歐美國家推薦使用吉西他濱聯用卡培他濱方案,或mFOLFIRINOX方案。而日本則推薦S-1方案。
ASCO 2019發表的APACT / III期試驗結果顯示,nab-紫杉醇聯用吉西他濱,對比單用吉西他濱,無病生存期(DFS)并未改善,但長期隨訪后的結果顯示,該方案在改善總生存期(OS)上顯示出了優越性。(J Clin Oncol 2019;37: abstract 4000)
圖表1:胰腺癌術后輔助化療的主要試驗
●局部晚期胰腺癌:化療和放化療,哪個更有效?
包括日本在內的各國治療指南中,針對局部晚期胰腺癌都推薦化療或放化療。但是哪個治療效果最佳,尚未達到共識。
歐美國家推薦在放化療前先誘導化療(放療前輔助使用化療)。但是,研究誘導化療是否有效的唯一隨機對照試驗JCOG1106/ II期試驗的結果顯示,S-1聯用放化療前追加誘導吉西他濱化療與否,并沒有顯著的差別。但是總生存期(OS)有所縮短(Ann Oncol 2016; 27: abstract 621PD)。因此,日本的《胰腺癌治療指南2019版》不推薦誘導化療。
局部晚期胰腺癌與遠處轉移胰腺癌都是不可手術的胰腺癌。但是目前尚未建立針對局部晚期胰腺癌的治療標準。因此默認遠處轉移胰腺癌的治療標準也適用于局部晚期胰腺癌。
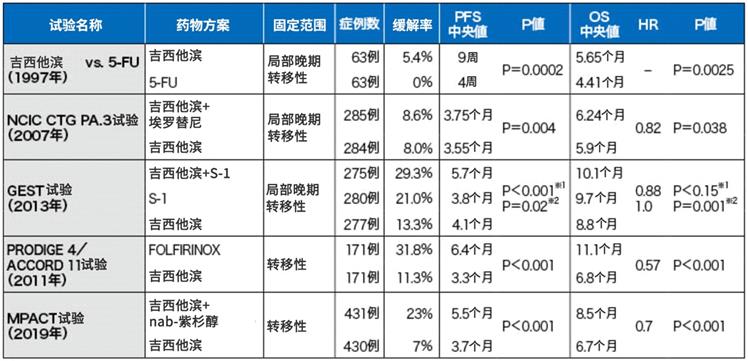
針對遠處轉移胰腺癌,FOLFIRINOX,吉西他濱聯用nab-紫杉醇,都比單用吉西他濱更能有效改善預后。除英國外的各國治療指南都推薦這兩個方案。
在日本進行的JCOG1407/ II期試驗是世界首個對比mFOLFIRINOX,吉西他濱聯用nab-紫杉醇方案的隨機對照試驗(Pancreatology 2018; 18: 841-845)。計劃在該研究的III期試驗中還會對上述最佳方案和放化療進行對比,以此制定標準治療方法。
圖表2:晚期胰腺癌一線治療的關鍵試驗
●轉移性胰腺癌:推薦派姆單抗作為二線治療藥物用于微衛星高度不穩定的患者
針對遠處轉移胰腺癌的一線治療,《2019年胰腺癌治療指南》推薦了FOLFIRINOX方案和吉西他濱聯用nab-紫杉醇方案。由于患者的身體狀態或年齡等原因不適用時,推薦單用吉西他濱,或者單用S-1,或者吉西他濱聯用埃羅替尼。海外III期試驗證實了這些方案的有效性。之后日本也相繼證實了各方案的有效性和安全性。
?FOLFIRINOX(N Engl J Med 2011; 364: 1817-1825)
?吉西他濱+nab-紫杉醇聯用(N Engl J Med 2013; 369: 1691-1703)
?單用吉西他濱(J Clin Oncol 1997; 15: 2403-2413)
?吉西他濱+埃羅替尼聯用(J Clin Oncol 2007; 25: 1960-1966)
另外,在日本和臺灣進行的GEST/ III期試驗的研究結果表明,S-1不遜于吉西他濱單藥治療(J Cancer Res Clin Oncol 2017; 143: 1053-1059)。在亞洲國家中,S-1單藥治療被作為標準治療之一。
針對遠處轉移胰腺癌的二線治療,《2019年胰腺癌治療指南》推薦使用派姆單抗用于以下情況。
①先采用吉西他濱為基礎的方案后,再采用氟尿嘧啶為基礎的方案
②先采用氟尿嘧啶為基礎的方案后,再采用吉西他濱為基礎的方案
③微衛星高度不穩定(MSI-H)
在以NTRK融合基因陽性為研究對象的3項試驗(STARTRK-2、STARTRK-1、ALKA-372-001)的綜合分析中,歐州臨床腫瘤學會(ESMO 2019)發表,ROS1/TRK抑制劑恩曲替尼有效(Ann Oncol 2018; 29: abstract LBA4)。該藥物于2019年6月在日本被批準。但是NTRK陽性胰腺癌非常罕見,不足胰腺癌患者的1%。
●免疫療法:通過改善腫瘤微環境來改善治療效果
PD-1/PD-L1/CTLA-4都在激活T細胞,從而抑制腫瘤細胞中擔當著重要角色。尤其是在惡性黑色素瘤等高免疫原性的腫瘤中,免疫檢查點抑制劑(ICI)具有很好的效果。
針對胰腺癌的治療,對比ICI單用和ICI聯用的幾個臨床試驗正在進行。但是治療成績并不理想。因此,胰腺癌的免疫治療只能作為聯合標準化療使用的輔助治療。然而,在一項針對微衛星高度不穩定(MSI-H)的研究中,派姆單抗已經取得了令人鼓舞的結果,并且有望在胰腺癌治療中使用。
腫瘤浸潤淋巴細胞(TIL)缺乏是ICI對胰腺癌無效的原因之一。因此,靶向TIL增殖或靶向腫瘤微環境的藥物與ICI組合的治療方法正在研發中。
抑制抗腫瘤免疫力的腫瘤浸潤調節性T細胞(Treg)高度表達趨化因子受體CCR4,在實體瘤患者的納武單抗和CCR4抗體 Mogamulizumab的I期試驗中,已顯示出了抗腫瘤活性和安全性(Clin Cancer Res 2019; 25: 6614-6622)。
在胰腺癌中,抑制T細胞抗腫瘤活性的腫瘤相關巨噬細胞(TAM)高度浸潤,而集落刺激因子1受體(CSF-1R)參與TAM的維持與分化。因此抑制CSF-1R可導致ICI效應增強。對比胰腺癌治療的納武單抗和CSF-1R抗體cabiralizumab的I期試驗結果顯示,CSF-1R抗體cabiralizumab實現了部分緩解(PR)(J Clin Oncol 2018; 36: abstract 3020、J Immunother Cancer 2017; 5: abstract O42)。是否聯合化療的II期試驗正在進行,以檢驗兩種藥物分別在有或沒有化療的情況下的療效。(J Clin Oncol 2019; 37: abstract TPS465)。
TGFβ是一種抑制抗腫瘤免疫的細胞因子。在對比PD-L1抗體和TGFβ抑制劑的M7824/I期試驗中,TGFβ抑制劑在胰腺癌治療中,實現了部分緩解(PR)和疾病穩定(SD)。(Clin Cancer Res 2018; 24: 1287-1295)。
盡管在日本已經積極開展了使用肽疫苗進行免疫療法的臨床研究,但是對比單用吉西他濱,吉西他濱聯用WT1多肽疫苗更加能夠顯著改善無進展生存期(PFS),這點在II期試驗中已經得到了驗證(Cancer Immunol Res 2018; 6: 320-331)。針對化療不敏感的胰腺癌,S-1聯用WT1的III期試驗正在進行(Trials 2019; 20: 242)。在海外,免疫組合療法(CRS-207 + GVAX Pancreas) 的效果已經獲得了喜人結果(J Clin Oncol 2015; 33: 1325-1333)。
此外,針對胰腺癌的嵌合抗原受體T細胞CAR-T的免疫療法的臨床試驗也在進行,結果值得期待。(Gastroenterology 2018; 155: 29-32)。
●靶向治療:PARP抑制劑對BRCA1/BRCA2突變有效
胰腺癌的驅動基因包括KRAS,CDKN2A,TP53,SMAD4等,但目前的治療靶點僅限于KRAS G12C和CDKN2A,基于基因突變的治療方案尚未成為標準治療。
參與DNA修復的基因突變(例如BRCA1 / 2,PALB2,ATM,ATR和ATRX)是最常見的突變,并且有相應的治療藥物。Ⅲ期POLO研究中,對于鉑類為基礎化療無進展的BCRA1/2胚系突變轉移性胰腺癌患者,PARP抑制劑奧拉帕尼的維持治療可以顯著延長無進展生存期(PFS)。(N Engl J Med 2019; 381: 317-327、「胰腺癌進入靶向治療新時代」)
基于該試驗結果,美國國立綜合癌癥網絡NCCN的胰腺癌治療指南中,將奧拉帕尼作為鉑類為基礎化療無進展的BCRA1/2胚系突變轉移性胰腺癌患者的維持治療。另外,維利帕尼 ,瑞卡帕布等PARP抑制劑尚在臨床試驗中。
另外有報導稱,在胰腺癌中,除了BRAF或EGFR突變,也會發現一些融合基因(FGFR、ALK、NTRK、NRG1等)的突變(Clin Cancer Res 2018; 24: 1344-1354)。在最新的NCCN胰腺癌指南中,“推薦使用全面的基因檢測來進行胚系突變檢測,以識別遺傳性癌癥綜合征。”,“局部晚期或轉移性胰腺癌,推薦行腫瘤/體細胞基因分析。”
●其他:液體活檢對檢測微小殘留病變非常重要。
奧坂團隊最后還提到了應用液體活檢的可能性。液體活檢對血液中的循環腫瘤細胞(CTC)和循環腫瘤DNA (ctDNA),以及外泌體進行監測。液體活檢是微創檢測,而且還具有以下優勢。
1、可以預測預后
2、可以及時監測治療反應和復發
3、尋找治療靶點
4、研究轉移癌的生物學特性和耐藥機制,有助于新藥開發。
液體活檢有望作為一種生物標記物檢測手段,應用于胰腺癌早期篩查和靶向治療。
奧坂還指出,對切除后微小殘留病變的檢測和診斷是今后研究的另外一個重要課題。


