基因編輯的T細胞如何對抗癌癥
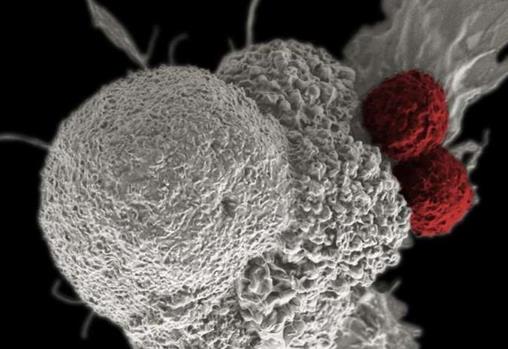
偽彩色掃描電子顯微照片顯示兩個T細胞(紅色)攻擊癌細胞(白色)。研究人員正在通過編輯T細胞內的基因來創造更強大的癌癥治療方法。圖片來源:Rita Elena Serda,美國貝勒醫學院鄧肯綜合癌癥中心,美國國家癌癥研究所,美國國立衛生研究院,CC BY-NC
在美國,基因編輯首次用于治療三名晚期癌癥得患者,并在1期臨床試驗中顯示出令人鼓舞的早期結果。到目前為止,該治療方法似乎是安全的,并且有望很快獲得更多結果。
在這種治療中,將患者自身的免疫細胞從體內提取,接受訓練以識別特定的癌細胞,然后最終將其注入患者體內,使其繁殖并破壞它們。與直接殺死癌細胞的化學療法或放射療法不同,免疫療法激活人體自身的免疫系統來發揮作用。這個團隊使用了一種叫做CRISPR的基因編輯工具來改變免疫細胞,將它們變成訓練有素的士兵來定位和殺死癌細胞。通過使用這種技術,研究小組希望開發一種副作用最小的更有效的免疫療法。
訓練免疫細胞以發現并殺死癌癥
癌癥藥物試驗的這些殺死腫瘤細胞的第一步是從癌癥患者的血液中分離出T細胞(一種與病原體和癌細胞對抗的白細胞)。該研究招募了兩名患有晚期多發性骨髓瘤的患者和一名患有類固醇/圓形細胞脂肪肉瘤的患者。
為了武裝T細胞并增強其抗腫瘤能力而又不損害正常細胞,科學家將T細胞進行了基因改造(禁用了三個基因,并添加了一個基因),然后再將其返回給患者。
這些缺失的基因中的前兩個編碼T細胞受體,T細胞受體是在T細胞表面上發現的蛋白質,可以識別并結合癌細胞上稱為抗原的特定分子。當這些經過改造的T細胞與這些抗原結合時,它使它們能夠攻擊并直接殺死癌細胞。但是問題是單個T細胞可以識別體內多種不同的抗原,從而使它們不太專注于尋找癌細胞。通過消除這兩個基因,T細胞不太可能攻擊錯誤的靶標或宿主,這種現象稱為自身免疫,
此外,他們破壞了第三個基因,稱為程序性細胞死亡蛋白1,該基因減慢了免疫反應。禁用程序性細胞死亡蛋白1基因可提高T細胞的效率。
這些細胞轉化的最后一步是添加一個基因,該基因產生一個新的T細胞受體,該受體識別并捕獲癌細胞上稱為NY-ESO-1的特定標記。現在刪除了三個基因,又添加了一個基因,這些T細胞就可以對抗癌癥了。
通過用CRISPR剪切掉三個基因并添加一個新的基因來修飾T細胞后,免疫細胞在定位和殺死癌細胞方面變得更好
CRISPR在這項臨床試驗中
那么,這個團隊如何精確地編輯T細胞?他們利用了CRISPR / Cas9基因編輯技術,該技術使用了兩個組件:一個可以找到并結合目標基因位點的CRISPR向導分子,一個分子剪Cas9剪切DNA,最終使基因失活。
該團隊使用電穿孔技術,該技術可在細胞膜上產生臨時孔,從而將Cas9蛋白與靶向分子的靶向分子一起傳遞給數百萬個T細胞中的三個感興趣的基因。
在使用CRISPR破壞了這三個基因后,研究小組使用了一種安全的,失活的病毒將一個基因傳遞給T細胞,從而使其能夠識別癌癥特異性標記物NY-ESO-1。從數百萬個細胞中去除這些基因,然后讓T細胞在培養皿中體外繁殖成數十億個細胞,可能需要幾天到幾周的時間。
在注射CRISPR修飾的T細胞前四天,研究小組為三名患者中的每人提供了幾劑化療藥物,以耗盡體內現有的白細胞。
最后,每公斤體重約有1億個修飾的T細胞作為單次輸注被注入患者體內。
CRISPR的光明前景
該小組在注射T細胞后的頭28天連續監測患者。然后,他們每月隨訪六個月。之后,每三個月監測一次不良事件,即免疫反應。T細胞療法通常與各種副作用有關,例如發燒,肌肉疼痛,頭痛,意識錯亂,癲癇發作,低血壓,出血性疾病和多器官功能障礙,研究小組沒有發現任何患者出現中毒的跡象,這令人興奮。
但是第一位患有晚期多發性骨髓瘤的患者在60天后仍繼續出現腫瘤。盡管對于第一位患者而言治療似乎并不那么成功,但1期臨床試驗主要是為了測試安全性,該小組報告對任何患者均無毒性。
使用串行CT掃描監測第二例患有晚期粘液樣/圓形細胞脂肪肉瘤的患者,并且在90天后似乎穩定。第三位多發性骨髓瘤患者最近開始試驗,尚無結果。這項基于CRISPR基因編輯技術的新療法對癌癥患者沒有嚴重的毒性問題,這是向臨床廣泛應用邁出的重要一步。


