ESMO2022 乳腺癌研究匯總
今年的歐洲腫瘤內科學會(ESMO)公布了眾多重要的研究結果,而這些結果將改變當前腫瘤的治療格局,會對未來的治療方向產生重大影響。其中,關于晚期乳腺癌就有很多令人期待的研究成果。以下,由日本國立癌癥研究中心中央病院的醫生下井辰徳為我們做個乳腺癌最新研究的匯總及解析。

日本國立癌癥研究中心中央病院
腫瘤內科主任醫師
下井 辰徳
① TROPiCS-02 研究:sacituzumab govitecan 顯著延長OS
【sacituzumab govitecan】
中文通用名: 戈沙妥珠單抗 or賽妥珠單抗
這是一款新型抗體偶聯藥物(ADC),由靶向TROP-2的抗體與化療藥物伊利替康(Irinotecan)的活性代謝物SN-38連接構成的抗體偶聯藥物(ADC)。它能夠通過與TROP-2蛋白相結合,將化療藥伊利替康的活性代謝物SN-38遞送到癌細胞內部。
ASCENT 試驗是一項隨機對照的 III 期臨床試驗,針對既往接受過至少2種化療的轉移性/復發性三陰性乳腺癌(TNBC)。該藥物因能夠提高無進展生存期 (PFS)和總生存期(OS),已被FDA批準用于治療三陰性乳腺癌(TNBC)。
目前正在進行的TROPiCS-02 研究 (ClinicalTrials.gov, ID: NCT03901339) 也是一項隨機對照的 III 期試驗。該試驗評估比較了 sacituzumab govitecan (SG組)和醫師選擇的治療(TPC組)對內分泌治療耐藥的 HR +/HER2-晚期乳腺癌患者的療效。
根據2022 年 ASCO 年會上報告的結果:
★無進展生存期(PFS)
SG 組:5.5 個月
TPC 組:4.0 個月
⇒SG 組的中位 PFS 優于 TPC 組(HR=0.66,95% CI: 0.53-0.83,p = 0.0003)
★6 個月 PFS 率
SG 組:46%
TPC 組:30%,
★12 個月 PFS率
SG 組:21%
TPC 組:7%,
⇒兩者都有利于 SG 組。
總生存期(OS),在第一次中期分析中無統計學上的明顯差異。SG組中性粒細胞減少的不良事件為51%,腹瀉為9%,但導致治療中止的嚴重不良事件SG組為6%,TPC組為4%,差異不大。
而此次ESMO 上公布的結果即為第二次中期分析結果。
★中位總生存期(OS)
SG 組:14.4 個月,
TPC 組:11.2 個月
⇒SG 組的 OS 明顯更好(HR= 0.79,95% CI: 0.65-0.96,p=0.020)。
★12 個月的 OS 率
SG 組:61%
TPC 組:47%
★反應率
SG 組: 21%,
TPC 組:14%(p=0.035)
⇒SG 組明顯更好。
Sacituzumab govitecan 是少數幾種治療 HR +/HER2 -晚期乳腺癌的藥物之一,與其他抗癌藥物相比,除了 PFS 外,OS 也有所改善。因此,該藥將被定位為HR+/HER2-晚期乳腺癌的標準治療方法之一。此外,一些 HER2 低表達的 HR+/HER2-乳腺癌病例與 Trastuzumab deruxtecan(德喜曲妥珠單抗/DS-8201)的病例重疊(Destiny Breast 04 研究)。未來也會考慮這兩種藥物的定位。
②MONARCH-3 研究:abemaciclib表現良好
【Abemaciclib】
中文通用名:阿貝西利
阿貝西利是一種 CDK4/6 抑制劑,在 HR +/HER2-中表現出顯著改善,被批準與非甾體芳香酶抑制劑(NSAI)聯合用作絕經后晚期乳腺癌患者的一線內分泌治療。該研究的次要終點 OS 的第二次中期分析已經發表。
★中位 OS(中位隨訪時間5.8 年)
在總體人群(ITT 人群)中,
阿貝西利+NSAI :67.1 個月,
安慰劑+NSAI : 54.5 個月
⇒未超過用于中期分析的預設 p 值,也未測試統計顯著性(HR=0.754;95% CI:0.584~0.974;p=0.0301)
在內臟轉移患者亞組(n=263)中,
阿貝西利+NSAI :65.1 個月,
安慰劑+NSAI : 48.8 個月
⇒即使在被認為預后不良的內臟轉移亞組中,使用 abemaciclib 改善 OS 的總體趨勢也得以維持(HR=0.708;95% CI:0.508-0.985,p = 0.0392)。
雖然還不能說OS有什么不同,但最終分析的結果是意料之中的。最終的 OS 分析結果定于明年公布,目前 CDK4/6 抑制劑的臨床使用沒有明確的差異。
然而,這些結果與PALOMA-2 試驗的最終 OS 結果不同,該試驗在 2022 年 ASCO 年會上公布,并沒有證明 OS 存在統計學上的顯著差異。亞組分析還顯示,阿貝西利的附加作用在內臟轉移等預后不良的患者中顯著,保持了以往 PFS 和 MONARCH2 OS 結果的特點。包括佐劑中各種 CDK4/6 抑制劑的結果,palbociclib(帕博西尼)和 阿貝西利之間的差異,以前被認為是等效的藥物,值得更多考慮。
③acelERA BC和 AMERA-3 試驗:口服單藥SERD研究結果陰性,但仍值得期待
SERD:是能下調雌激素受體(ER)水平和活性的藥物。
氟維司群注射液是一種選擇性雌激素受體下調劑(SERD),是現有 SERD 中唯一上市的藥物,需要肌肉注射。而目前正在研發的口服SERD有望克服AI治療過程中出現的與AI耐藥相關的ESR1基因突變。(AI治療,主要是指芳香化酶抑制劑類藥物,屬于內分泌治療)
在一項開放標簽、隨機對照 III 期試驗中, Elacestrant(艾拉司群)已被證明對比醫生選擇的內分泌治療可改善 PFS 。目前,多家制藥公司正在開發口服SERD,此次會議上公布了兩項開放標簽、隨機對照的II期試驗結果。
【acelERA BC 試驗】
研究納入了既往接受過1~2線治療(必須包含內分泌治療)的ER+/HER2-局部晚期或轉移性乳腺癌,將口服 SERD 藥物giredestrant 與醫師選擇的內分泌單藥療法(TPC組)進行了比較。結果,giredestrant 未能顯示出 PFS 的顯著改善。
★ INV 評估的中位 PFS(中位隨訪時間為7.89個月),
giredestrant 組:5.6 個月
TPC 組:5.6 個月
風險比為 0.81(95% CI 0.60-1.10,p = 0.1757)
★6 個月 PFS 率
giredestrant 組:46.8%
TPC 組:39.6%
⇒giredestrant 組呈有利趨勢。
★ESR1突變陽性患者的中位 PFS
giredestrant 組(51 例患者):5.3 個月
TPC 組(29 例患者):3.5個月
⇒giredestrant 組有利的,但差異不明顯(HR=0.60, 95% CI: 0.35-1.03,p = 0.0610)
【AMEERA-3試驗】
AMEERA-3是一項隨機、開放標簽、II期臨床試驗,旨在評估amcenestrant單藥治療vs醫生選擇的單藥內分泌治療(包括氟維司群、阿那曲唑、來曲唑、依西美坦以及他莫昔芬)在既往接受過激素治療的ER+/HER2-局部晚期或轉移性乳腺癌患者中療效和安全性。研究的主要終點是由獨立中心審查評估的PFS,研究的次要終點包括總生存期(OS)、客觀緩解率(ORR)、疾病控制率(DCR)、臨床獲益率(CBR)、緩解持續時間(DoR)以及安全性和生活質量評估。
結果,
★中位 PFS
amcenestrant 組:3.6 個月
TPC 組:3.7 個月
⇒沒有顯著差異(HR=1.051,95% CI:0.789-1.4,p=0.6437),
★ESR1突變陽性患者的中位 PFS
amcenestrant 組:3.7 個月
TPC 組:2.0 個月
⇒沒有顯著差異(HR=0.9,95% CI;0.565-1.435 , p = 0.6437)
下表總結了上述三種藥物的試驗結果:
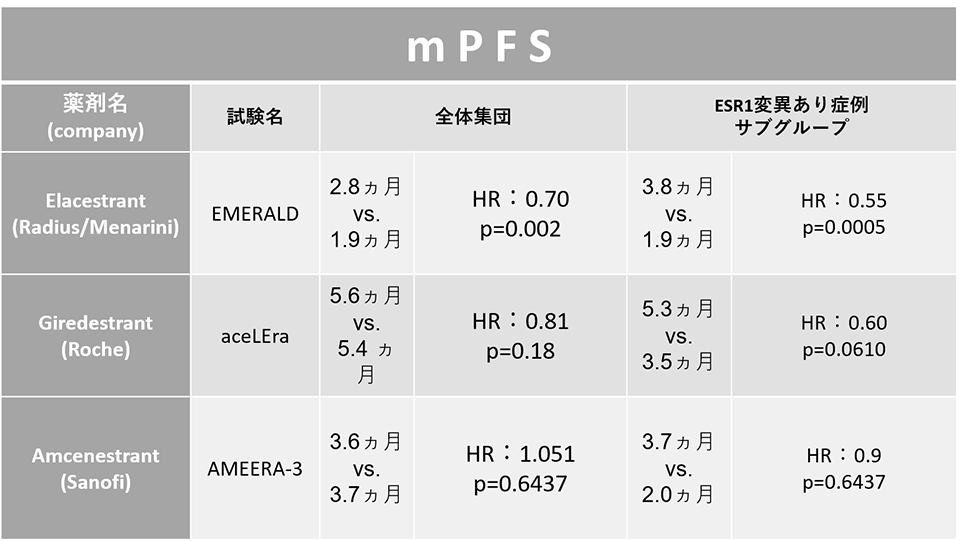
口服SERD的開發目前處于第一線,一些一線治療III期試驗正在進行中,但這些結果給它們蒙上了一層陰影。口服SERD在ESR1突變病例中的療效一直被認為是合理的。但是,未來,我們將等待目前正在進行的 III 期對比試驗的結果,看看它是否真的比現有的 AI 等內分泌療法和氟維司群更有效。(AMEERA-5 試驗已被宣布為陰性試驗。)
④DATA 試驗:部分患者可能會從延長內分泌治療中獲益
DATA 試驗(ClinicalTrials.gov:NCT00301457)是在荷蘭進行的一項前瞻性、隨機對照、開放標簽的Ⅲ期臨床試驗。旨在研究在他莫昔芬輔助內分泌治療 2-3 年后未復發的 HR+絕經后乳腺癌患者,延長內分泌治療的最佳時間等。患者被隨機分配接受 3 年的阿那曲唑(833 名)或 6 年的阿那曲唑(827 名)。主要終點為調整的無病生存期(aDFS),定義為隨機化3年后的DFS。次要研究終點為調整的總生存期(aOS)。
★10年調整的aDFS率
6年治療組:69.1%,
3年治療組:66.0%
⇒HR=0.86,95% CI 0.72-1.01,p = 0.073,差異無統計學意義。
★10 年調整的總生存期(aOS)
6 年治療組: 80.9%
3 年治療組:79.2%
⇒HR=0.93,95% CI:0.75-1.16,p = 0.53,未觀察到顯著差異。
進一步亞組分析顯示: 10年調整的aDFS率
★ER +/ PR+
6 年治療組:70.8%
3 年治療組:64.4%
HR=0.77,95% CI:0.63-0.93,p=0.018
★淋巴結轉移,ER +/ PR+
6 年治療組: 68.7%
3 年治療組:60.7%
HR=0.74,95% CI:0.59-0.93,p = 0.011
★腫瘤≥2 cm ,淋巴結轉移,ER+/PR+
6 年治療組: 70.7%
3 年治療組:66.4%
HR=0.64 , 95% CI .47-0.88, p = 0.005
中位隨訪 5 年時DFS 沒有顯著差異。此次最終報告也顯示 DFS 結果為陰性。這些亞組的 10 年 aOS 率沒有顯著改善。
★淋巴結轉移,ER +/ PR+
6 年治療組:81.4%
3 年治療組:76.7%
HR=0.84,95% CI: 0.63-0.93,p=0.23
★腫瘤≥2 cm ,淋巴結轉移,ER+/PR+
6 年治療組:80.6%
3 年治療組:72.5%
HR=0.71,95% CI: 0.48-1.05,p=0.084
迄此,5 年內分泌治療的療效研究包括 AERAS、MA17、NSABP-B33、NSABP-B42、DATA、GIM4等大型隨機對照試驗。根據日本乳腺癌學會 2022版診療指南的綜合分析表明,內分泌治療 5 年后的 DFS 與 5 年后延長 AI 給藥相比有所改善,這一趨勢已得到認可。然而,GIM4 研究是唯一顯示 OS 改善的隨機對照試驗,并且延長內分泌治療在匯總分析中并不顯著。
此外,由于現在已知延長AI會增加不良事件,如骨質疏松癥的惡化和心血管事件的增加,所以應根據估計的復發基線風險、芳香化酶抑制劑的耐受性和額外的不良事件等因素來綜合考慮延長AI。
近年來,研究者們還設計了一些指數來評估芳香化酶抑制劑治療五年以上的療效。例如乳腺癌復發指數BCI。它是通過使用FFPE標本,以RT-PCR 為基礎的多基因檢測方法;還有CTS5評分,它根據腫瘤直徑、等級、年齡和淋巴結轉移的數量來計算復發風險,對于評估絕經后病例在第五年開始的復發風險很有幫助。這些指標可能有助于篩選出最能延長內分泌治療中獲益的人群。


