日本:“光免疫療法”最新動態
關于光免疫療法,日本就醫網從2018年開始一直在跟蹤報道。作為術手、放療、化療和免疫治療之后的“第種五治療方法”,光免疫療法自提出以來一直備受關注。
該療法由美國國立衛生研究院主任研究員小林久隆團隊開發,是一種將對人體無害的光(近紅外光)和免疫療法結合,擁有雙重效果的最新療法,能夠通過光線照射破壞癌細胞,同時喚醒人體對體內癌細胞的免疫反應。日本在2021年已將光免疫療法作為“不可切除的局部晚期或局部復發性頭頸部癌”的治療方法納入保險范圍,領先于世界其他國家,為全世界患者開啟治療新篇章。
目前,日本全國約20家醫院可以實施光免疫療法,部分已開放接收國際患者,符合光免疫療法適應癥要求的頭頸部癌的患者可以前往日本就醫。
什么是光免疫療法
光免疫療法,實際上是兩種癌癥治療技術“光動力治療”和“抗體治療”相結合的產物。通過給患者注射能夠與癌細胞相結合的光敏藥物,并從體外照射近紅外線,使藥物引起化學反應,從而殺滅癌細胞的一種新型治療方法。
該藥物由西妥昔單抗結合光敏染料IR700組成。西妥昔單抗是一種對抗表皮生長因子受體EGFR的單克隆抗體,與R700結合后形成一種新型抗體偶聯藥物(ADC藥物)。*以下稱該光敏藥物為RM-1929。
(首款藥物Akalux®及與之搭配使用的激光系統BioBlade®已于2020年在日本獲批)
圖1:光免疫療法的概述
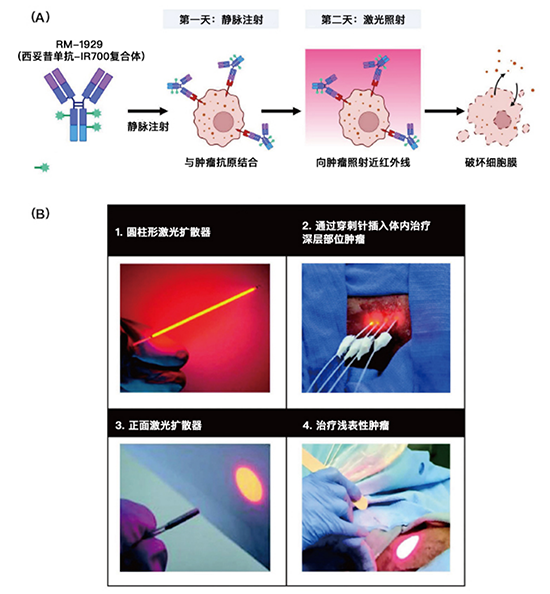
靜脈注射RM-1929藥物24±4小時后,通過激光擴散器進行激光(近紅外線)照射以激活光敏染料IR700,對其所結合的癌細胞產生細胞毒性作用。
關于光免疫療法的詳細介紹(機制,適應癥,注意事項,治療步驟,副作用,治療費用等)可點擊以下參考或咨詢。
以下,我們總結了光免疫療法在局部復發性頭頸部癌的I/IIa期多中心、開放標簽研究的數據和結果,包括藥物推薦劑量、安全性、藥代動力學、免疫原性以及初步的治療效果。
(Head Neck 2021; 43: 3875-3887)
I期試驗結果:確定了RM-1929的推薦藥物劑量為640mg/m2,淺表腫瘤的最佳光劑量50J/cm2,深層組織病變的最佳光劑量100J/cm。未出現影響持續治療的嚴重不良事件。
【試驗方法】
受試者為18歲或以上,經組織病理學診斷為鱗狀細胞癌,ECOG PS為0-2,手術或放療后復發的頭頸部癌癥患者。 如果沒有禁忌癥,則事先進行含鉑藥物的化療。排除標準是腫瘤侵犯大血管,而未進行血管栓塞/支架或血管結扎,腫瘤位于激光照射無法到達的區域,腎功能不全,肝功能受損和西妥昔單抗的輸液反應史。但遠處轉移不被認為是排除標準。
第一天,靜脈注射RM-1929,時間大概需要2小時;
第二天,用專用激光設備系統進行激光照射。
對淺表性腫瘤(厚度<1厘米)使用正面激光擴散器,對深層組織腫瘤使用圓柱形擴散器,必要時對腫瘤內多個點位進行照射。在使用圓柱形擴散器時,17號針頭以1.8±0.2cm的間隔均勻放置在腫瘤內,并在超聲引導下進行照射,以覆蓋整個腫瘤體積。
第I期試驗評估了固定光照劑量下藥物RM-1929的推薦劑量和相關的安全性。主要終點是確定最大耐受劑量(MTD)或可施用的最大給藥量(MFD),以較低者為準,確定固定光照度下藥物劑量的安全性,以及確定最小紅斑量(MED)。
MTD被定義為:6例受試者中至少有1例出現低于劑量限制性毒性(DLT)一個級別。
MFD被定義為:根據以前報道的西妥昔單抗的藥代動力學(PK)特性,認為足以使腫瘤組織中的EGFR結合達到飽和的RM-1929的劑量。
在確定推薦劑量時,起始劑量為160mg/m2,按照標準3+3的設計,滴定到320mg/m2和640mg/m2。光劑量的選擇標準是基于達到MTD或在一個治療周期后產生明顯的腫瘤萎縮的光劑量。 其他終點包括腫瘤反應、PK和免疫原性評估。
不良事件使用國際醫學用語詞典(MedDRA )18.0版進行編碼,不良事件的強度由美國國家癌癥研究所的不良事件通用術語標準(NCI-CTCAE)4.03版進行評估。
為了評估腫瘤反應,研究期間進行的CT和PET檢查的圖像由影像診斷專家使用mRECIST 1.1、PERCIST(IIa期部分)和Choi標準(用于評估腫瘤密度/壞死)進行解析。影像診斷根據mRECIST 1.1和Choi標準,從未確定的客觀反應率(ORR)獲得完全緩解(CR)或部分緩解(PR)的患者比例。 確認的ORR被定義為在初次評估后至少四周,通過第二次影像評估確認為CR或PR的患者比例。
【試驗結果】
★9名患者入選,每個劑量級別3人。
★關于不良反應
在任何劑量水平上都沒有觀察到明確的劑量限制性毒性(DLT)。在MED評估期間,有2名患者觀察到輕度可逆的皮膚光敏反應。一些患者發生的3級或以上的不良事件是口腔和激光照射部位的疼痛。沒有觀察到導致治療中止的不良事件。
當RM-1929 劑量為640 mg/m2時,3名患者中有1名出現完全緩解CR,1名患者出現疾病穩定SD。9名患者中有7名(77.8%)實現了疾病控制(CR、PR、SD);
當RM-1929 劑量為160mg/m2時,3名患者全部實現了SD;
當RM-1929 劑量為320mg/m2時,3名患者中有2名實現了SD。
所有患者都在臨床上或放射學上觀察到腫瘤的縮小。此外,RM-1929劑量在640 mg/m2時,平均曲線下面積(AUC)0-∞超過了單用西妥昔單抗所證明的EGFR飽和所需的AUC 0-∞。基于上述,建議將640mg/m2作為IIa期的給藥方案。
最佳光劑量被定義為RM-1929 的MFD產生足夠的抗腫瘤效果(定義為治療后1個月腫瘤明顯縮小)的光強度。RM-1929所有劑量水平(160、320、640 mg/m2)中,正面擴散器為50 J/cm2,圓柱形擴散器為100J/cm,通過臨床或放射學評估腫瘤減小。因此,推薦的藥物劑量被確定為640 mg/m2,最佳的激光強度對于淺表性腫瘤是50 J/cm2,對于深層腫瘤是100J/cm.
IIa期試驗結果:對于不可切除的復發性頭頸部癌,光免疫療法的不良事件在可接受范圍內,且療效很高。未確定的ORR為43.3%,確定的ORR為26.7%,中位OS為9.3個月,4個CR病例(13%)。
【試驗方法】
IIa期試驗的主要目標是確定可接受的安全性和臨床療效的最佳激光強度(在I期確定的RM-1929劑量下),并評估多達四個周期的重復治療的安全性。其他終點是評估安全性、PK、免疫原性和與重復治療有關的反應。 基于I期的安全性和有效性結果,IIa期要評估的RM-1929劑量被固定為640 mg/m2,激光強度被固定為淺表性腫瘤50 J/cm2,深層腫瘤100J/cm。I期給予一個周期的治療,而IIa期則給予最多四個周期的治療。
【試驗結果】
★31名患者入選,其中30人接受了RM-1929光免疫療法。
★關于不良事件
在30名受試者中,最常見的不良事件是疲勞、吞咽困難、便秘、紅斑和周圍水腫。
19名(63.3%)患者出現3級或以上不良事件;5名(16.7%)患者因不良事件而中止治療,但只有1例被判定為與治療有關,即血肌酐升高。13名(43.3%)患者出現的嚴重不良事件中,有3起被認為與治療有關(腫瘤疼痛、口腔疼痛和氣管梗阻)。
在開始治療的5周內,還有3名(10%)患者發生了導致死亡的嚴重不良事件(腫瘤出血、動脈出血、肺炎)。 這些事件發生在最后一次治療后19天以上,似乎主要與腫瘤反應或腫瘤侵犯血管有關,不被認為是治療本身導致的不良事件。
★反應率為66.7%;
-未確認的客觀緩解率(ORR):43.3%;
其中4例(13.3%)患者實現了完全緩解CR,9例(30.0%)患者顯示出部分緩解PR。24例(80.0%)患者觀察到疾病控制(定義為CR+PR+疾病穩定SD)。
-確認的客觀緩解率(ORR):26.7%;
-中位總生存期(OS):9.30個月;
(表)IIa期試驗的反應率
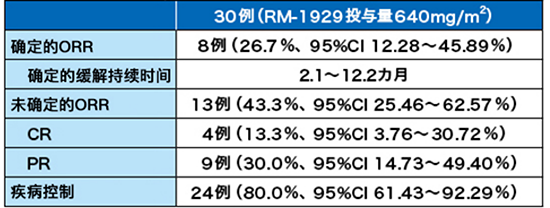
圖2:靶病灶的變化率
顯示了光免疫治療后靶病灶的變化率。使用Choi標準來量化腫瘤體積和密度的CT變化,反應率為66.7%(95% CI :47.19-82.71%)。
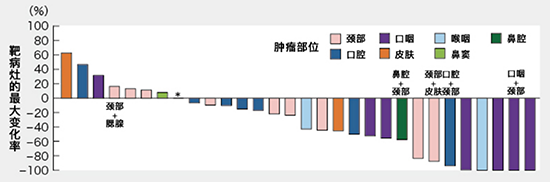
圖3:總生存期(OS)
中位總生存期(OS)為9.30個月(95% CI:5.16-16.92個月)。
★在接受治療的30名患者中,有10名既往接受過抗PD-1抗體治療,并出現腫瘤進展,而其他20名沒有接受過抗PD-1抗體治療。既往接受過和未接受過PD-1抗體治療的客觀緩解率ORR比例分別為30%(95%CI:6.67?65.25%),25%(95%CI:8.66-49.10%),沒有顯著差異。
12個月的生存率為49.8%(14名患者),18個月的生存率為29.1%(6名患者)。 在對I/IIa期所有患者的ad-hoc分析中,24個月的生存率為27.9%(9名患者)。 值得注意的是,在最后一次長期隨訪(22.18-32.33個月)時,有4名患者未接受治療,目前仍在生存。在治療前接受活檢的25名患者中,沒有發現EGFR表達與腫瘤反應性之間的關聯。
這些結果表明,在既往接受過復發治療的患者中,光免疫療法的治療效果非常好,而且持續有效。這意味著光免疫療法可能會改善總生存期OS。
目前,國際III期試驗正在進行。III期試驗將補充I/IIa期試驗病例數量不足,沒有充分評估生活質量和緩解持續時間的局限性,同時驗證該療法在腫瘤萎縮、延長生存期和改善生活質量方面的作用。光免疫療法有望成為局部晚期復發性頭頸部癌的新治療選擇,我們期待III期試驗的結果。
目前,光免疫療法主要集中于對局部腫瘤的治療效果上,尚無關于對遠處轉移影響的報道。但正如“光免疫治療“的名稱所示,通過激活全身性腫瘤免疫減少遠處轉移,或與免疫檢查點抑制劑ICI聯合使用提高治療效果將是下一個值得期待的話題。


